Actualites

Actualites

Actualites

Reglementation des dispositifs medicaux

Actualites

Reglementation des dispositifs medicaux

Reglementation des dispositifs medicaux

Reglementation des dispositifs medicaux

Reglementation des dispositifs medicaux

Actualites

Actualites

Actualites

Reglementation des dispositifs medicaux
Actualites

Reglementation des dispositifs medicaux

Reglementation des dispositifs medicaux
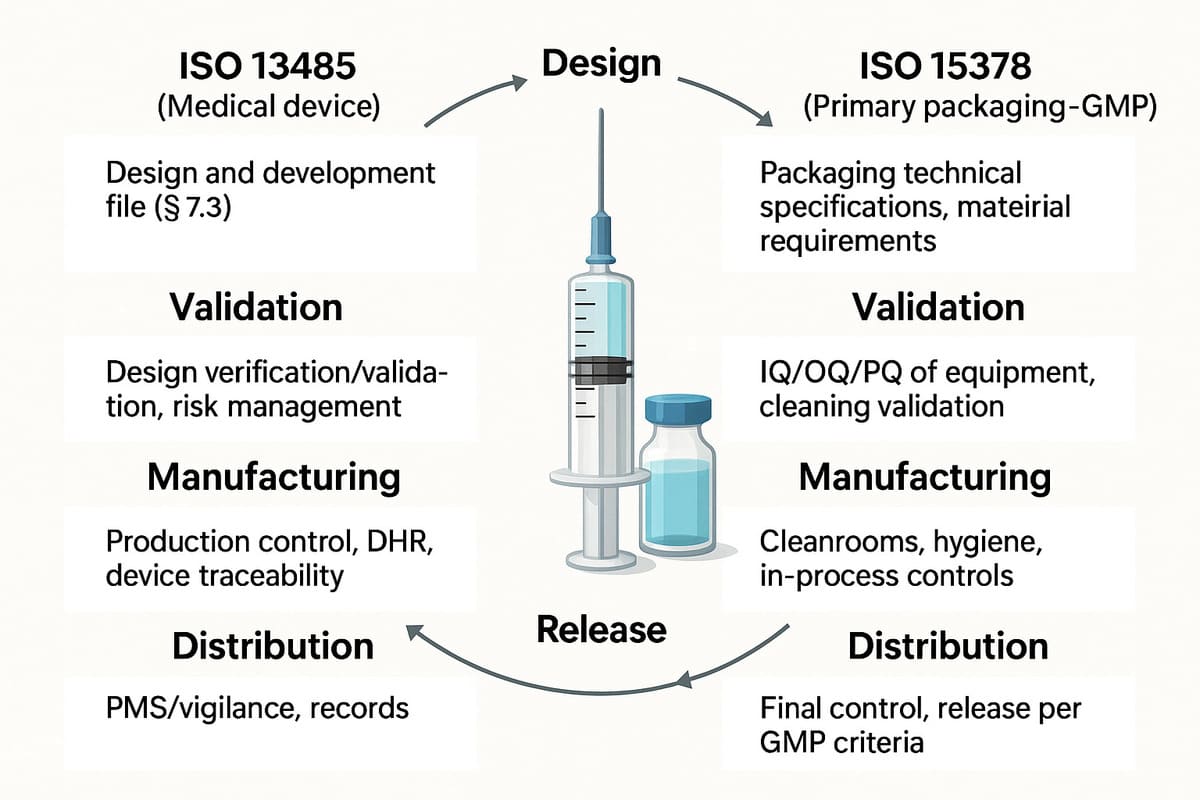
Reglementation des dispositifs medicaux

Actualites

Actualites

Actualites

Reglementation des dispositifs medicaux