Combination products : les passerelles entre ISO 13485 et ISO 15378 (et ce qu’en attendent les autorités)
Reglementation des dispositifs medicaux
1. Quand deux mondes qui se rencontrent
Les produits combinés, ou combination products, sont au croisement de deux univers réglementaires exigeants : celui des dispositifs médicaux et celui des médicaments.
Qu’il s’agisse d’un auto-injecteur, d’une seringue préremplie ou d’un patch transdermique, ces produits posent une question simple mais stratégique : quelle norme qualité faut-il appliquer ?
ISO 13485 ? ISO 15378 ? Les deux ? Cet article vous guide pour comprendre les passerelles entre ces deux référentiels et surtout ce qu’en attendent réellement les autorités de santé et vos clients.
2. ISO 13485 et ISO 15378 : deux référentiels issus de l’ISO 9001, mais pour des besoins différents
Ce qu’ils ont en commun :
Tous deux reposent sur la logique de l’ISO 9001 : approche processus, PDCA, documentation maîtrisée.
Tous deux s’appliquent à des produits réglementés.
Tous deux exigent une gestion structurée des risques et des modifications.
Ce qui les distingue :
|
ISO 13485 |
ISO 15378 |
|
Norme de SMQ spécifique aux dispositifs médicaux |
Norme de SMQ appliquée aux emballages primaires pour médicaments |
|
Intègre les exigences du MDR 2017/745 et des autorités comme la FDA (QMSR) |
Intègre les exigences GMP (Bonnes Pratiques de Fabrication) attendues dans le monde pharma |
|
Centrée sur le produit fini (DM) |
Centrée sur les composants d’emballage en contact direct avec le médicament |
À retenir : ISO 13485 s’adresse aux fabricants légaux de dispositifs médicaux ; ISO 15378 vise plutôt les fournisseurs pharmaceutiques d’emballages critiques. Mais les frontières deviennent floues dans le cas des produits combinés.
3. Quels cas exigent l’un, l’autre… ou les deux ?
Voici quelques cas typiques pour vous situer :
|
Vous êtes… |
ISO 13485 |
ISO 15378 |
Certification attendue ? |
Remarques |
|
Titulaire d’un produit combiné (AMM + marquage CE) |
✅ |
✅ |
Pas forcément les deux, mais justification exigée |
Double conformité attendue : DM + médicament |
|
Fabricant du dispositif d’administration (auto-injecteur, pompe, patch…) |
✅ |
⚠️ si contact médicament |
Oui (ISO 13485) |
ISO 13485 exigée si le dispositif est conçu ou modifié |
|
Fabricant de l’emballage primaire (seringue, flacon, bouchon, capsule…) |
❌ |
✅ |
Oui (ISO 15378 ou GMP équivalent) |
ISO 15378 est la norme de référence attendue |
|
Sous-traitant full-service (CDMO, OEM) |
✅ |
✅ |
Recommandé, selon le rôle dans le projet |
Souvent évalué par audit client plutôt que certification double |
|
Distributeur de produit combiné |
❌ |
❌ |
Non, mais responsabilités à vérifier |
Doit s’assurer que les fabricants et CMO sont conformes |
Important : les normes ne sont pas automatiquement obligatoires, mais les exigences sous-jacentes (traçabilité, validation, hygiène, risques…) le sont. Il faut pouvoir en démontrer l’application effective.
4. Ce qu’en attendent les autorités (UE, FDA, clients pharma)
4.1. Côté Europe (EMA + MDR)
Le MDR 2017/745 ne couvre pas explicitement les produits combinés, mais impose une évaluation conjointe (notified body + autorité compétente médicament) pour les dispositifs intégrant une substance médicamenteuse.
Le fabricant DM doit démontrer la conformité ISO 13485, et la partie médicamenteuse doit respecter les GMP.
4.2. Côté FDA (21 CFR Part 4)
La FDA impose la conformité simultanée à :
21 CFR Part 820 (bientôt alignée avec ISO 13485) pour le DM
21 CFR Part 210/211 pour le médicament
Les combination products sont donc doublement concernés. La FDA propose un guide pour la répartition des responsabilités qualité.
4.3. Côté clients pharma
Ils exigent généralement que les fournisseurs d’emballage ou de composants critiques soient ISO 15378 certifiés, ou démontrent des pratiques GMP équivalentes.
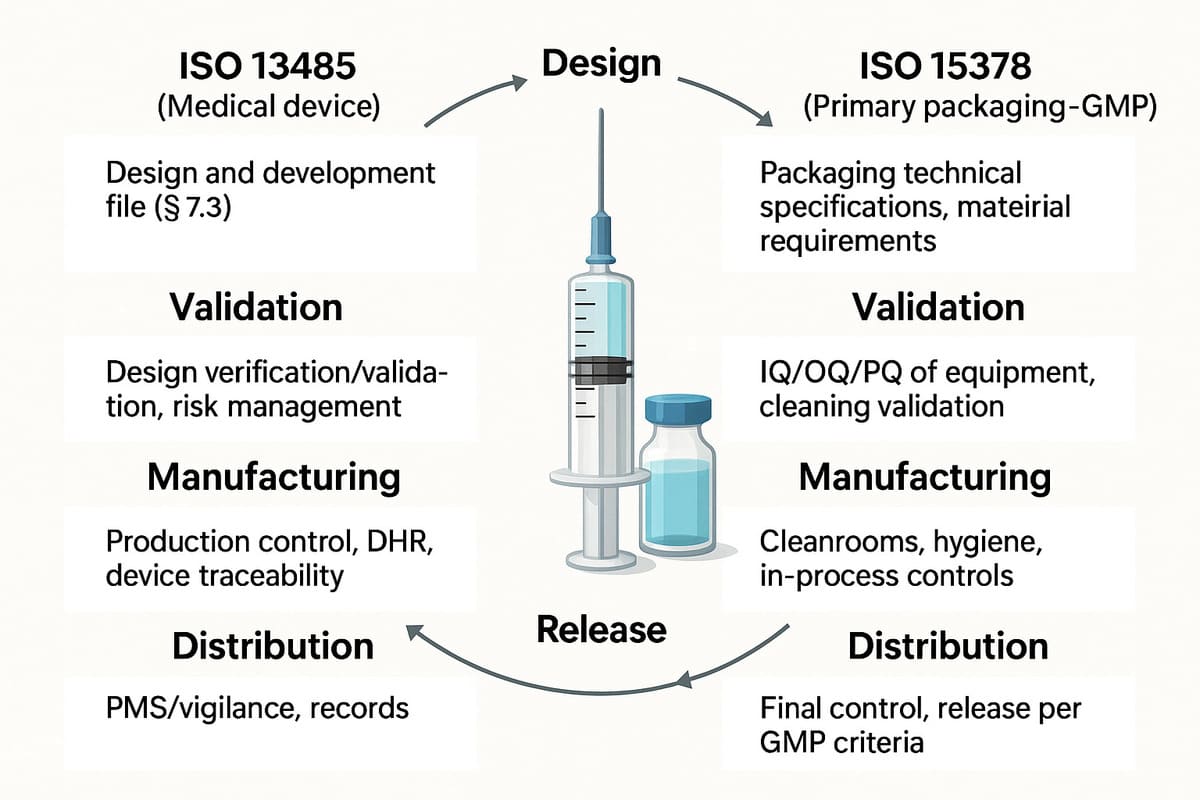
4.4. Un cycle de vie, deux logiques qualité à coordonner : ISO 13485 vs ISO 15378, étape par étape
Même si ISO 13485 et ISO 15378 reposent sur des principes communs (SMQ, risques, validation…), elles s’appliquent différemment selon les étapes du cycle de vie du produit combiné.
Voici un aperçu croisé des exigences typiques à chaque étape :
|
Étape |
ISO 13485 (Dispositif médical) |
ISO 15378 (Emballage primaire - GMP) |
|
Conception |
Dossier de conception (§ 7.3) |
Spécifications techniques packaging, exigences matériaux |
|
Validation |
Vérification / validation du design, gestion des risques |
Qualification IQ/OQ/PQ des équipements, validation nettoyage |
|
Fabrication |
Maîtrise de la production, DHR, traçabilité DM |
Zones propres, hygiène, contrôles en cours de production |
|
Libération |
Revue de lot, conformité au design |
Contrôle final, libération selon critères GMP |
|
Distribution |
PMS / vigilances, enregistrements |
Revue des enregistrements de lot, traçabilité matière |
Ce double pilotage qualité nécessite une coordination documentaire, opérationnelle et réglementaire. C’est là que la cohérence du SMQ global devient un enjeu stratégique.
5. Cas pratiques
Cas 1 : Auto-injecteur prérempli (start-up biotech)
Le client développe un médicament injectable, conditionné dans un dispositif de type pen injector.
Il conçoit le dispositif lui-même, avec un partenaire sous-traitant.
Ce qu’on applique :
ISO 13485 pour la partie dispositif + marquage CE.
Application des exigences GMP (par le partenaire qui fabrique le conditionnement primaire) → ISO 15378 ou équivalent exigé.
Coordination essentielle dans le dossier technique pour justifier les responsabilités croisées.
Cas 2 : Fabricant de flacons et bouchons pour dispositifs nasaux
Fournisseur de composants plastiques moulés, contact direct avec le médicament.
Le client final est un laboratoire pharmaceutique qui assemble ces composants avec un DM.
Ce qu’on applique :
ISO 15378 obligatoire (traçabilité matière, environnement propre, validation du nettoyage).
Pas de besoin ISO 13485 sauf si les composants sont revendiqués comme DM ou partie intégrante.
Ces deux cas illustrent combien l’application de l’ISO 13485 et de l’ISO 15378 dépend du rôle exact dans la chaîne de valeur.
6. Mini FAQ
Dois-je avoir les deux certifications (13485 + 15378) ?
Pas forcément. Mais vous devez pouvoir démontrer que toutes les exigences sont effectivement mises en œuvre (y compris BPF).
Est-ce que l’ISO 9001 suffit ?
Non. Ni pour le dispositif (ISO 13485 nécessaire), ni pour l’emballage primaire (ISO 15378 ou GMP).
Et si je ne fais que distribuer le produit ?
Vous ne serez pas forcément certifié, mais vous devez vous assurer que vos fournisseurs le sont.
Une société peut-elle avoir un seul SMQ couvrant les deux normes ?
Oui, c’est même recommandé. Il faut alors cartographier clairement les exigences spécifiques dans votre documentation qualité.
7. Une double culture qualité indispensable
Les produits combinés obligent à sortir des silos réglementaires. Il ne suffit pas d’avoir un SMQ “DM” ou “Pharma” : il faut savoir combiner les exigences et parler les deux langages.
Chez CSDmed, nous aidons les fabricants à bâtir une stratégie qualité cohérente pour les produits combinés : du choix des référentiels à l’organisation documentaire, en passant par la gestion des sous-traitants. Parlons-en.
8. Ressources associées
DM ou pas DM ? Ce que dit (vraiment) le guide ANSM sur les cas frontières (avril 2025)
FDA vs MDR : 5 différences qui comptent pour un fabricant de DM