Règlement d’exécution (EU) 2022/2346 et (EU) 2023/1194 des dispositifs en Annexe XVI du MDR 2017/745 - gestion des risques et dispositions transitoires
Reglementation des dispositifs medicaux
Certains dispositifs sans destination médicale prévue sont néanmoins soumis au règlement MDR 2017/745 relatif aux dispositifs médicaux. Ils sont considérés comme ayant des risques comparables aux dispositifs médicaux et sont listés dans l’Annexe XVI du MDR.
Le règlement d’exécution (UE) 2022/2346 modifié par le règlement d’exécution (UE) 2023/1194 définit les spécifications communes pour ces produits sans finalité médicale. Les dispositions transitoires et les exigences en matière de gestion des risques y sont décrites.
Rappel des attentes du MDR 2017/745 concernant les produits de l’Annexe XVI
Pour les dispositifs visés à l'annexe XVI, les exigences générales en matière de sécurité établies aux points 1 et 8 de l’Annexe I chapitre I sont interprétées en ce sens que le dispositif, utilisé dans des conditions normales et conformément à sa destination, présente un risque nul ou un risque qui n'est pas supérieur au risque maximum acceptable lié à l'utilisation du produit, de manière à garantir un niveau élevé de protection de la sécurité et de la santé des personnes.
Des exigences générales
Les exigences générales en matière de Gestion des Risques et d’informations utilisateurs sont décrites dans l’Annexe I du règlement d'exécution (EU) 2023/1194.
⚠️ Gestion des risques
Le processus de gestion des risques est rappelé (et il reste très proche des principes de l'ISO 14971) :
- planification de la gestion des risques (GDR);
- Références et description du dispositifs
- Liste des activités de gestion des risques à mener
- Spécification des phases du cycle de vie du dispositifs couvertes par la GDR
- Roles et responsabilités
- Critères d’acceptabilité des risques*
- Critères pour la collecte d’information en production et en post-production
- identification des dangers et analyse des risques;
- Dans des conditions normales d’utilisation et dans le cas de mauvaise utilisation raisonnablement prévisible.
- Estimation de la gravité et de la probabilité de survenue de dommages
- évaluation des risques;
- Déterminer sur les risques sont acceptables
- maîtrise des risques et évaluation des risques résiduels;
- Liste des mesures de maitrise des risques et évaluation de leur efficacité
- Liste des risques résiduels après réduction des risques
- Maitrise des risques dans l’ordre de préférence suivant:
- a) l’intégration de la sécurité à la conception;
- b) l’intégration de la sécurité à la fabrication;
- c) les mesures de protection dans le dispositif lui-même ou au sein du processus de fabrication;
- d) les informations de sécurité et, le cas échéant, la formation des utilisateurs.
- examen de la gestion des risques;
- Vérifier que les procédures de gestion des risques ont été respectées
- Le risque résiduel global est acceptable, et les risques éliminés ou réduits autant que possible.
- activités de production et de postproduction.
- Processus de collecte et d’examen des informations
* Concernant les critères d’acceptabilité, voici ce que nous précise le règlement d’exécution:
Les fabricants tiennent compte du fait que tous les risques, y compris les risques liés à une intervention chirurgicale, doivent être éliminés ou réduits autant que possible. Si les effets secondaires indésirables sont de nature passagère et ne nécessitent pas d’intervention médicale ou chirurgicale pour prévenir une maladie mettant en danger la vie du patient, une déficience permanente d’une fonction anatomique ou l’altération permanente d’une structure anatomique, les risques résiduels peuvent être considérés comme étant acceptables. Si une ou plusieurs des conditions énoncées à la présente section ne sont pas remplies, le fabricant fournit une justification pour démontrer l’acceptabilité des risques.
📄 Informations de sécurité
- La destination étant non médicale, les informations ne doivent contenir aucune allégation au bénéfice clinique
- Étiquette
- Porte la mention «destination non médicale:» suivie d’une description de cette destination non médicale.
- Si possible, les informations relatives aux catégories d’utilisateurs;
- les performances attendues du dispositif;
- les risques découlant de l’utilisation du dispositif.
- Notice d’utilisation
- Comprend les informations relatives aux catégories d’utilisateurs;
- Description des performances attendues du dispositif (quel effet non médical peut être attendu de l’utilisation du dispositif);
- Description des risques résiduels du dispositif, y compris les mesures de maîtrise associées, présentée d’une manière claire et aisément compréhensible, afin que le consommateur puisse décider en connaissance de cause s’il souhaite être traité avec ce dispositif, se le faire implanter ou l’utiliser de toute autre façon;
- La durée de vie attendue ou la période de résorption attendue du dispositif ainsi que tout suivi nécessaire;
- Renvoi à toute norme harmonisée et à toute spécification commune qui s’applique au dispositif.
Des exigences spécifiques
Les exigences spécifiques pour chaque type de produit listé en Annexe XVI du MDR 2017/745 sont listées dans les Annexes II à VII du règlement 2022/2346.
Les dispositions transitoires pour les dispositifs à visée non médicale
Les règles sont définies dans l’Article 2 du règlement 2022/2346, et ont été amendées par le règlement modificatif 2023/1194. En substance, voici ce qu’il faut retenir:
Conditions générales
- le produit était déjà commercialisé légalement dans l’Union avant le 22 juin 2023 et continue de respecter les exigences du droit de l’Union Européenne et du droit national qui lui étaient applicables avant le 22 juin 2023
- il n’y a pas de modification significative de la conception et de la destination prévue du produit.
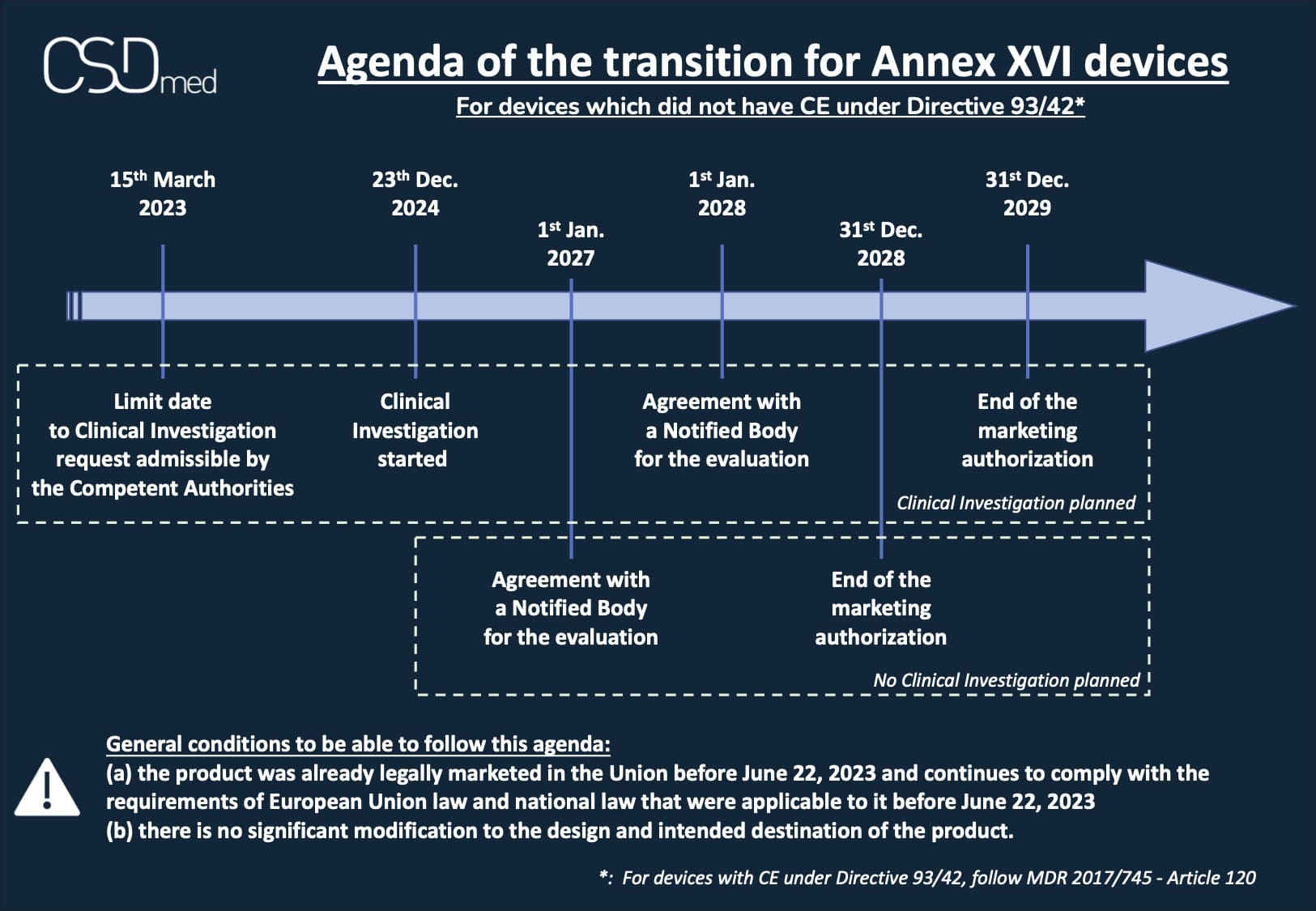
Dispositifs qui n'avaient pas de CE sous Directive 93/42
Calendrier s'il y a une Investigation Clinique (IC) prévue (au plus tard):
- 22 juin 2024 : demande d'IC recevable par les Autorités Compétentes (Article 2 - 1 du EU 2022/2346)
- 23 décembre 2024 : l'IC a débuté (Article 2 - 1 du EU 2022/2346)
- 1er janvier 2028 : accord avec un Organisme Notifié (ON) pour l'évaluation (Article 2 - 1 du EU 2022/2346 amendé)
- 31 décembre 2029 : fin de l'autorisation de mise sur le marché (Article 2 - 1 du EU 2022/2346 amendé)
Calendrier s'il n'y a pas d'IC prévue (au plus tard):
- 1er janvier 2027 : accord avec un Organisme Notifié (ON) pour l'évaluation (Article 2 - 2 du EU 2022/2346 amendé)
- 31 décembre 2028 : fin de l'autorisation de mise sur le marché (Article 2 - 2 du EU 2022/2346 amendé)
Dispositifs qui avaient un CE sous Directive 93/42
Calendrier identique à celui du MDR Article 120, en voici le rappel :
- 26 mai 2021 : application du MDR aux dispositifs de classe I ou à tous nouveaux dispositifs
- 20 mars 2023 : accord avec un Organisme Notifié (ON), ou Autorité Compétente, ou CE sous MDD
- 26 mai 2024 : demande après d’un Organisme Notifié (ON) et SMQ en accord avec le MDR
- 26 septembre 2024 : accord avec un Organisme Notifié (ON) pour l'évaluation
- 26 mai 2026 : fin de l'autorisation de mise sur le marché pour les dispositifs de classe III implantable sur mesure
- 31 décembre 2027 : fin de l'autorisation de mise sur le marché pour les dispositifs de classe III et IIb implantable
- 31 décembre 2028 : fin de l'autorisation de mise sur le marché pour les dispositifs de classe IIb non-implantable et IIa
Vous pouvez consulter notre article sur Le calendrier selon le règlement modificatif 2023/607.
Nous sommes à votre service
Depuis l’arrivée du Règlement 2017/745, de nouvelles exigences sont demandées et font partie de la documentation à présenter à l’organisme notifié (par exemple revue de l’évaluation clinique poussée, procédure de PMS, résultats de CQ issus de la validation des produits, preuves de compétences du personnel, etc.).
CSDmed apporte son expertise et une approche méthodique à ses clients, start-ups, fabricants, importateurs et distributeurs de dispositifs médicaux, grâce à une équipe d’experts et de consultants spécialisés, qui pourront traiter la transition MDR dans son entièreté.
🔗 Contactez-nous et découvrez comment nous pouvons vous aider.