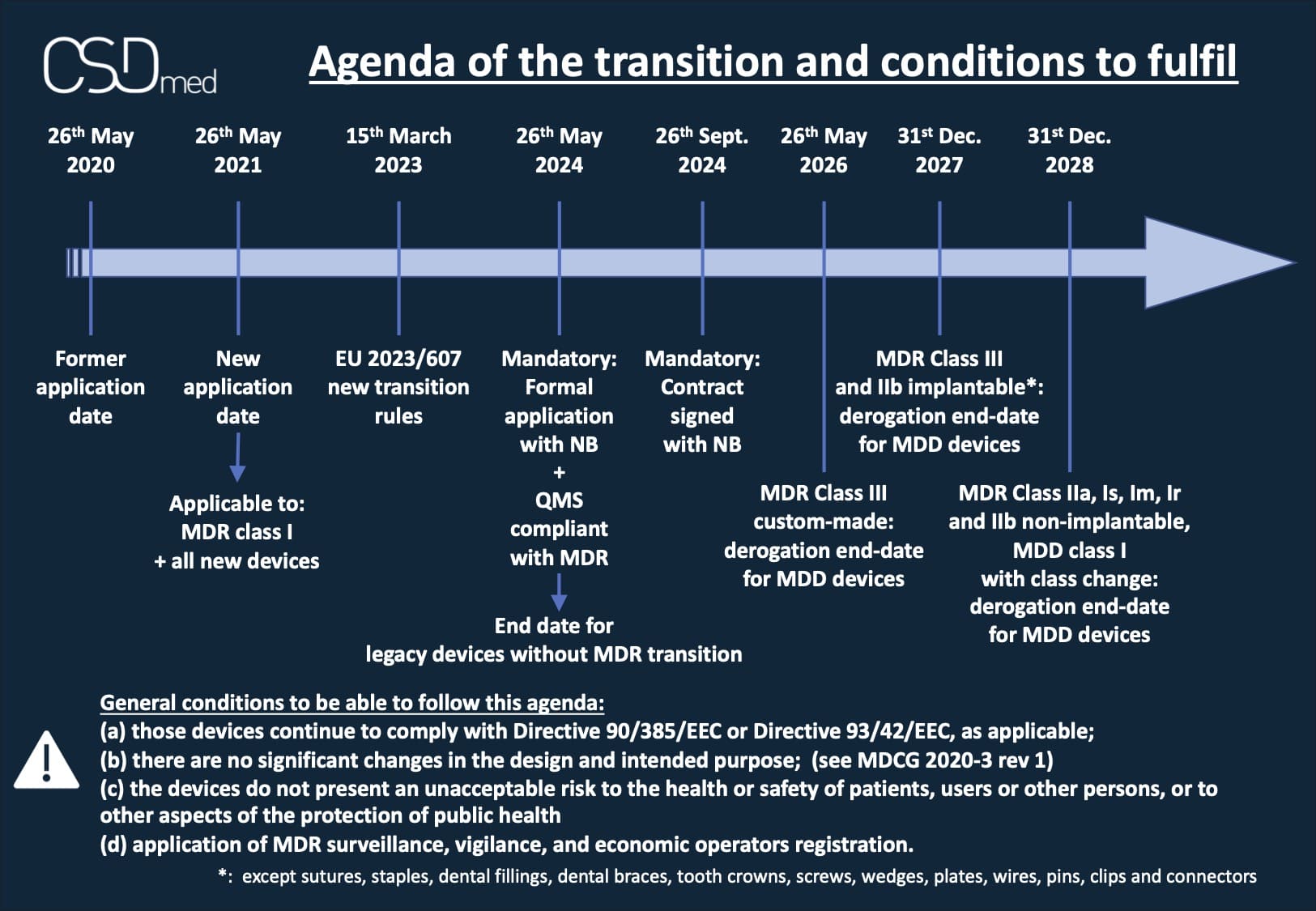
Le calendrier selon le règlement modificatif 2023/607
Reglementation des dispositifs medicaux
Beaucoup de nos clients nous posent des questions sur le calendrier à prendre en compte depuis la publication et entrée en vigueur (en procédure accélérée) de l’amendement au MDR 2017/745, le fameux EU 2023/607, applicable depuis le 15 mars 2023.
Les obligations pour bénéficier de la période de transition étendue :
Maintien de la validité des certificats MDD (ou de la déclaration de conformité) :
- Le certificat est valide au 26 Mai 2021 et non retiré
- + si certificat échu à la date d’entrée en vigueur du règlement rectificatif (15/03/2023) :
- Contrat signé avec un ON conformément à l’Annexe VII, section 4.3, avant expiration certificat MDD du DM concerné ou un DM amené à le substituer* (Article 120, section 2a)
- Une autorité compétente a accordé une dérogation selon l’Article 59 ou a demandé au fabricant de mettre en oeuvre la procédure d’évaluation applicable selon l’Article 97 (Article 120, section 2b)
- Pour les DM de classe I sous MDD qui changent de classe : Déclaration de Conformité (DoC) valide au 26 Mai 2021 (Article 120, section 3 ter)
* Un dispositif est destiné à remplacer un dispositif suite à un ou des changement(s) significatif(s) de la conception, et/ou des performances, et/ou de l’utilisation prévue.
Conditions à remplir pour la mise sur le marché :
- Conformité au MDD (Article 120, section 3 quater - a)
- Pas de changement significatif dans finalité et/ou conception (Article 120, section 3 quater - b et voir le guide MDCG 2020-3 rev 1)
- Pas de risque inacceptable (Article 120, section 3 quater - c)
- Mise en place d’un SMQ conforme MDR avant le 26 mai 2024 (surveillance, vigilance, et enregistrement des opérateurs économiques) - (Article 120, section 3 quater - d)
- Dépôt d’une demande formelle auprès d’un Organisme Notifié avant le 26 mai 2024 et contrat signé avec l’ON avant le 26 Sept 2024 (Article 120, section 3 quater - e)
- Application de la Surveillance Après Commercialisation (SAC), surveillance du marché, vigilance, enregistrement des opérateurs et produits selon MDR (Article 120, section 3 quinquies)
Si les conditions sont remplies, le dispositif médical ayant pour vocation de passer sous MDR ou ayant pour vocation de remplacer un DM sous MDD verra sa mise sur le marché directement applicable.
Autre apport de l’amendement 2023/607
L’amendement apporte également l’abrogation de la fin de période de mise à disposition.
Comment savoir que le fabricant dispose de la période de transition ?
- Les certificats actuels sous MDD ne seront pas modifiés par les Organismes Notifiés (extension « by law »)
- Le fabricant pourra établir une « Self-déclaration » - un modèle est disponible ici
- L’Organisme Notifié pourra établir une « Confirmation letter » - un modèle est disponible ici
- L'autorité compétente peut délivrer un « certificat de libre vente »
Si l’Organisme Notifié sélectionné pour le MDR est différent de l’ON qui avait émis le certificat sous MDD, un agrément tripartite devra être rédigé. La surveillance par le nouvel ON sous MDR se fera au plus tard le 26 sept 2024. Le nouvel ON ne sera pas pour autant responsable de la surveillance précédente) - Article 120 section 3 sexies.
Un modèle de contrat tripartite a été proposé par la Team NB et est disponible ici
Que se passe-t-il à partir de 2029 ?
- Tous les dispositifs médicaux mis sur le marché doivent être conformes au règlement MDR 2017/745
- Les dispositifs conformes au MDD présents dans les circuits de distribution ou chez l’utilisateur (vendus ou en dépôt) peuvent être écoulés/utilisés sans limite de temps autre que date limite d’utilisation.
- Les DM conformes à la directive déjà installés chez l’utilisateur peuvent continuer à être utilisés pendant leur durée de vie.
Nous sommes à votre service
Depuis l’arrivée du Règlement 2017/745, de nouvelles exigences sont demandées et font partie de la documentation à présenter à l’organisme notifié (par exemple revue de l’évaluation clinique poussée, procédure de PMS, résultats de CQ issus de la validation des produits, preuves de compétences du personnel, etc.).
CSDmed apporte son expertise et une approche méthodique à ses clients, start-ups, fabricants, importateurs et distributeurs de dispositifs médicaux, grâce à une équipe d’experts et de consultants spécialisés, qui pourront traiter la transition MDR dans son entièreté.
🔗 Contactez-nous et découvrez comment nous pouvons vous aider.